醫用無菌包裝常見的有軟包裝和硬吸塑包裝,均需要經過醫用無菌熱合機封口后才能進行下一項滅菌的操作。常使用的滅菌方法有輻射滅菌法、干熱滅菌法、濕熱滅菌法、環氧乙烷滅菌法、臭氧滅菌法等等,其中的選擇可以根據產品包裝材料和實際需求進行確定。下面介紹一下各種滅菌方法的特點。

滅菌物品置于適宜放射源輻射的γ射線或適宜的電子加速器發生的電子束中進行電離輻射而達到殺滅微生物的方法。本法最常用的60Co-γ射線 輻射滅菌。醫療器械、容器、生產輔助用品、不受輻射破壞的原料藥及成品等均可用本法滅菌。
γ射線輻射滅菌所控制的參數主要是輻射劑量(指滅菌物品的吸收劑量)。該劑量的制定應考慮滅菌物品的適應性及可能污染的微生物最大數量及最強抗輻射力,事先應驗證所使用的劑量不影響被滅菌物品的安全性、有效性及穩定性。對最終產品、原料藥、某些醫療器材應盡可能采用低輻射劑量滅菌。滅菌前應對被滅菌物品微生物污染的數量和抗輻射強度進行測定,以評價滅菌過程賦予該滅菌物品的無菌保證水平。
滅菌時應采用適當的化學或物理方法對滅菌物品吸收的輻射劑量進行監控, 以充分證實滅菌物品吸收的劑量是在規定的限度內。
將物品置于干熱滅菌柜、隧道滅菌器等設備中,利用干熱空氣達到殺滅微生物或消除熱原物質的方法。適用于耐高溫但不宜用濕熱滅菌法滅菌的物品滅菌,如玻璃器具、金屬材質容器、纖維制品、固體試藥、液狀石蠟等均可采用本法滅菌。
干熱滅菌條件一般為160~170℃*120min以上、170~180℃*60min以上或250℃*45min以上,也可采用其他溫度和時間參數。應保證物品滅菌后的無菌狀態,此時物品一般無需進行滅菌前污染微生物的測定。250℃*45min的干熱滅菌也可除去無菌產品包裝容器及有關生產灌裝用具中的熱原物質。
采用干熱滅菌時被滅菌物品應有適當的裝載方式,不能排列過密,以保證滅菌的有效性和均一性。
干熱滅菌法應確認滅菌柜中的溫度分布符合設定的標準及確定最冷點位置等。 常用的生物指示劑為枯草芽孢桿菌孢子(Spores of Bacillus subtilis )。細菌內毒素滅活驗證試驗是證明除熱原過程有效性的試驗。一般將小于1000單位的細菌內毒素加入待去熱原的物品中,證明該去熱原工藝能使內毒素至少下降3個對數單位。細菌內毒素滅活驗證試驗所用的細菌內毒素一般為大腸埃希菌內毒素 。
將物品置于壓力蒸汽滅菌器內利用高壓飽和蒸汽、過熱水噴淋等手段使微生物菌體中的蛋白質、核酸發生變性而殺滅微生物的方法。該法滅菌能力強, 為熱力滅菌中最有效、應用最廣泛的滅菌方法。藥品、容器、培養基、無菌衣、膠塞以及其他遇高溫和潮濕不發生變化或損壞的物品,均可采用本法滅菌。流通蒸汽不能完全殺滅細菌孢子,一般可作為不耐熱無菌產品的輔助滅菌手段。
濕熱滅菌條件通常采用121℃*15min、121℃*30min、或116℃*40min的程序,也可采用其他溫度和時間參數,但必須保證物品滅菌后無菌狀態。對熱穩定的物品,可采用過度殺滅法。熱穩定性較差產品的標準滅菌時間 F0[指滅菌溫度為121℃,生物指示菌的耐熱參數D值為1分,滅菌溫度系數Z值為10.0℃時的標準滅菌時間(121℃下計算的微生物等效滅活率)]一般不低于 8min。如產品的熱穩定性很差時,可允許濕熱滅菌的F0低于8,此情況下應在生產全過程中,對產品中污染的微生物嚴加監控,并采取各種措施降低微生物污染水平,確保被滅菌產品達到無菌保證要求。
采用濕熱滅菌時,被滅菌物品有適當的裝載方式,不能排列過密,以保證滅 菌的有效性和均一性。
濕熱滅菌法應確認滅菌柜在不同裝載時可能存在的冷點。當用生物指示劑進 一步確認滅菌效果時,應將其置于冷點處。本法生物指示劑為嗜熱脂肪芽孢桿菌孢子。
環氧乙烷又名氧化乙烯,在低溫下為無色液體,具有芳香醚味,沸點為10.8℃,嗅閾值為760 mg/m~1064mg/m,密度為1.52;環氧乙烷易燃易爆,其最低燃燒濃度為3%。環氧乙烷氣體穿透力強。
環氧乙烷氣體殺菌力強、殺菌譜廣,可殺滅各種微生物包括細菌芽孢屬滅菌劑。 環氧乙烷不損害滅菌的物品且穿透力很強,故多數不宜用一般方法滅菌的物品均可用環氧乙烷消毒和滅菌。例如,電子儀器、光學儀器、醫療器械、書籍、文件、皮毛、棉、化纖、塑料制品、木制品、陶瓷及金屬制品、內鏡、透析器和一次性使用的診療用品等。環氧乙烷是目前最主要的低溫滅菌方法之一。
臭氧是一種強氧化劑,滅菌過程屬生物化學氧化反應。O3滅菌有以下3種形式:
臭氧能氧化分解細菌內部葡萄糖所需的酶,使細菌滅活死亡。
直接與細菌、病毒作用,破壞它們的細胞器和DNA、RNA,使細菌的新陳代謝受到破壞,導致細菌死亡。
透過細胞膜組織,侵入細胞內,作用于外膜的脂蛋白和內部的脂多糖,使細菌發生通透性畸變而溶解死亡。
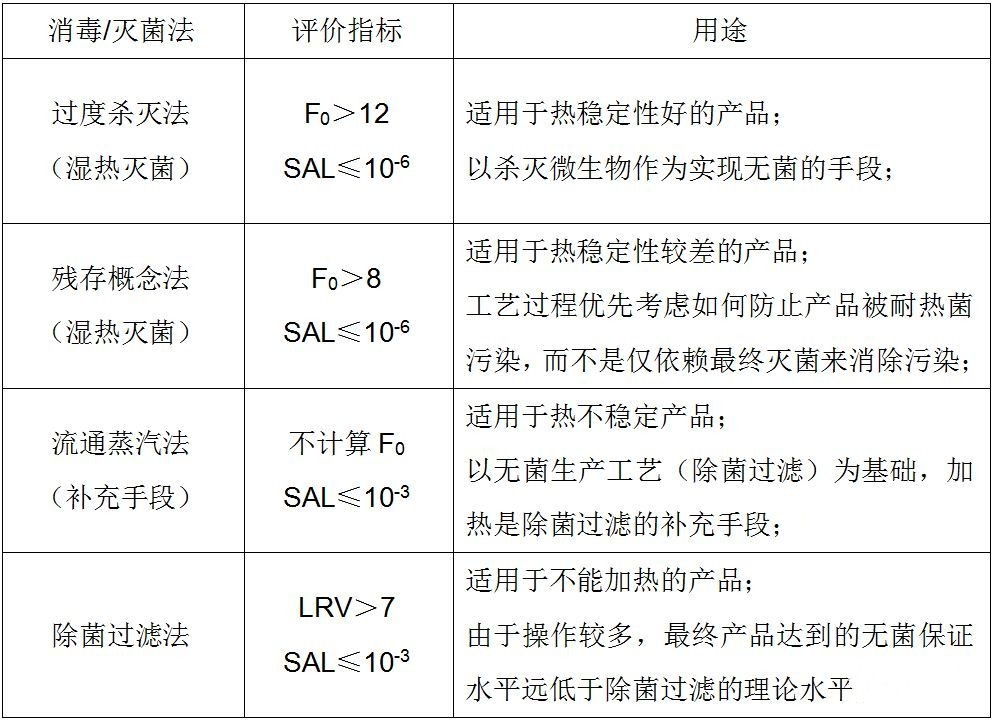
以上5種滅菌方法,僅為介紹參考,詳細使用應根據實際情況進行選擇,保障醫用器械設備滅菌后的無菌狀態。下圖無菌狀態評價指標對照表可以做一下參考。